Chemijoje ryšiai tarp atomų yra būtini norint suprasti, kaip elementai jungiasi ir formuoja įvairias chemines medžiagas. Joniniai ir kovalentiniai ryšiai yra du pagrindiniai būdai, kuriais atomai jungiasi, formuodami molekules ir kitas struktūras. Nors abu ryšiai yra būtini molekulių formavimuisi, jie skiriasi savo prigimtimi, savybėmis ir pasekmėmis medžiagoms. Šiame straipsnyje aptarsime, kas yra joninis ir kovalentinis ryšys, ir išnagrinėsime jų skirtumus.
Kas yra joninis ryšys?
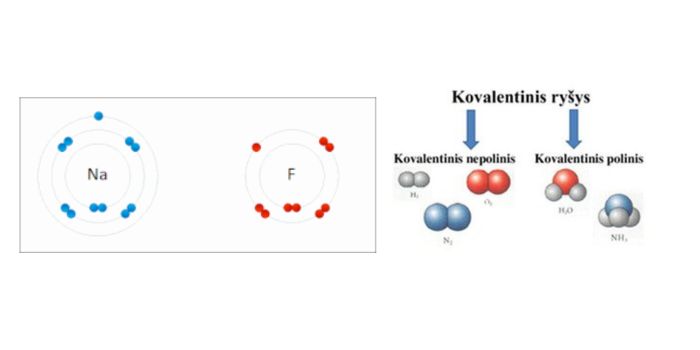
Joninis ryšys yra cheminis ryšys, kuris susidaro tarp dviejų atomų, kai vienas atomas perduoda elektroną kitam atomui, taip formuodamas priešingai įelektrintus jonus. Paprastai, joninis ryšys susidaro tarp metalo ir nemetalo. Metalo atomas praranda vieną ar daugiau elektronų, tampa teigiamuoju jonu (kationu), o nemetalas įgyja tuos elektronus, tampa neigiamuoju jonu (anijonu). Pavyzdžiui, natrio chloridas (NaCl) yra būdingas joninio ryšio atvejis, kuriame natrio (Na) atomas perduoda elektroną chloro (Cl) atomui. Dėl šio elektronų perėjimo abu atomai tampa joniais ir traukia vienas kitą elektrostatinėmis jėgomis, formuodami stabilų junginį.
Kas yra kovalentinis ryšys?
Kovalentinis ryšys yra cheminis ryšys, kuris susidaro, kai du atomai bendrai naudoja vieną ar daugiau porų elektronų. Šis ryšys paprastai susidaro tarp dviejų nemetalų. Kovalentiniame ryšyje elektronų pora yra traukiama abiejų branduolių, todėl elektronai yra dalijamasi tarp atomų, o ne perduodami, kaip joniniame ryšyje. Pavyzdžiui, vandenilio molekulė (H2) susidaro, kai du vandenilio atomai dalijasi savo vieninteliais elektronais, formuodami tvirtą junginį. Kovalentinis ryšys yra labai stiprus ir suteikia molekulėms didelį stabilumą.
Apibendrinant
Joninis ir kovalentinis ryšiai yra du pagrindiniai mechanizmai, per kuriuos atomai jungiasi ir formuoja molekules. Joninis ryšys remiasi elektronų perdavimu ir elektrostatine trauka tarp priešingai įelektrintų jonių, o kovalentinis ryšys remiasi elektronų dalijimosi principu tarp atomų. Šie skirtumai lemia skirtingas molekulių savybes, įskaitant jų tirpumą, lydymosi ir virimo temperatūras bei mechanines savybes. Supratimas apie šiuos skirtumus yra esminis norint įvertinti medžiagų elgseną ir jų panaudojimą įvairiose pramonės šakose.
Šaltiniai: