Chemijoje labai svarbu suprasti, kuo skiriasi kovalentinis polinis ir nepolinis ryšys, kad būtų galima suprasti, kaip molekulės sąveikauja ir elgiasi. Šie ryšių tipai atlieka pagrindinį vaidmenį nustatant junginių fizikines ir chemines savybes.
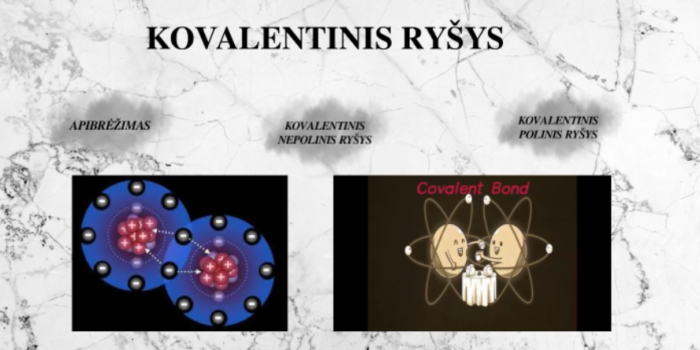
Kas yra kovalentinis polinis ryšys?
Kovalentinis polinis ryšys – tai toks cheminis ryšys, kai du atomai dalijasi elektronų pora, tačiau jie dalijasi jais nevienodai. Taip atsitinka dėl to, kad vienas ryšio atomas turi didesnę trauką elektronams (didesnį elektroneigiamumą) nei kitas. Todėl bendri elektronai daugiau laiko praleidžia arčiau atomo, kurio elektroneigiamumas didesnis, todėl ryšyje atsiranda nedidelis elektrinis poliariškumas. Tai reiškia, kad vienas ryšio galas yra šiek tiek neigiamas, o kitas – šiek tiek teigiamas. Dažnas poliarinio kovalentinio ryšio pavyzdys yra vanduo (H2O), kuriame deguonies atomas turi didesnį elektroneigiamumą nei vandenilio atomai.
Kas yra nepolinis kovalentinis ryšys?
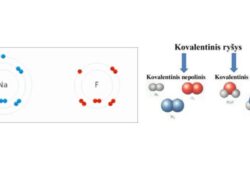
Kovalentinis nepolinis ryšys – tai cheminio ryšio tipas, kai du atomai vienodai dalijasi elektronų pora. Tai paprastai pasitaiko tarp to paties elemento atomų arba tarp skirtingų elementų, kurių elektroneigiamumas panašus. Kadangi elektronai dalijami vienodai, ryšyje nėra didelio krūvio atskyrimo. Tai reiškia, kad ryšys neturi teigiamų ir neigiamų polių, o molekulė apskritai būna elektriškai subalansuota. Nepolinio kovalentinio ryšio pavyzdys yra azoto dujų (N2) molekulė, kurioje abu azoto atomai vienodai dalijasi elektronais.
Pagrindiniai skirtumai
- Elektronų pasiskirstymas: Poliariniuose ryšiuose elektronai dalijami nevienodai dėl skirtingo elektroneigiamumo. Nepoliarinėse jungtyse elektronai dalijami po lygiai.
- Elektrinis poliškumas: Poliarinės jungtys sukuria dipolį, t. y. abiejuose jungties galuose yra daliniai teigiami ir neigiami krūviai. Nepolinėse jungtyse toks krūvių atskyrimas neegzistuoja.
- Susijusių atomų tipai: Poliariniai kovalentiniai ryšiai dažnai susidaro tarp skirtingų elementų atomų, o nepolariniai kovalentiniai ryšiai dažniausiai susidaro tarp identiškų arba labai panašaus elektroneigiamumo atomų.
- Fizikinės savybės: Poliariškumas turi įtakos tokioms savybėms kaip tirpumas, virimo temperatūra ir lydymosi temperatūra. Polinių molekulių virimo ir lydymosi temperatūros paprastai būna aukštesnės ir jos dažniau tirpsta vandenyje nei nepolinės molekulės.
- Cheminė elgsena: Polinės ir nepolinės molekulės skirtingai sąveikauja su kitomis medžiagomis. Poliarinės molekulės gali sąveikauti dipolinėmis-dipolinėmis sąveikomis ir vandeniliniais ryšiais, o nepolinės molekulės dažnai sąveikauja van der Valso jėgomis.
Išvada
Apibendrinant galima teigti, kad pagrindinis kovalentinių polinių ir nepolinių jungčių skirtumas yra tas, kaip elektronai yra dalijami tarp dalyvaujančių atomų ir koks yra jų elektrinis poliškumas. Poliarinės jungtys pasižymi nevienodu elektronų pasiskirstymu ir daliniais krūviais, todėl pasižymi skirtingomis fizikinėmis ir cheminėmis savybėmis. Nepolinės jungtys, kuriose elektronai dalijami po lygiai ir krūviai nėra atskirti, taip pat pasižymi specifinėmis savybėmis, turinčiomis įtakos molekulių elgsenai. Šių skirtumų supratimas yra labai svarbus chemijos ir medžiagotyros mokslui.
Šaltiniai: