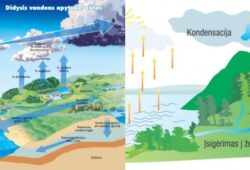
Virimas ir garavimas yra du skirtingi procesai, susiję su skysčių virsmu garais. Nors abu procesai apima skysčio pavertimą garais, jie vyksta skirtingomis sąlygomis ir turi skirtingas savybes. Šiame straipsnyje aptarsime pagrindinius skirtumus tarp virimo ir garavimo, paaiškinsime, kaip šie procesai veikia ir kokiomis sąlygomis jie vyksta.
Kas yra virimas?
Virimas yra procesas, kai skystis virsta garais visame savo tūryje pasiekęs tam tikrą temperatūrą, vadinamą virimo tašku. Tai reiškia, kad skystis verda ne tik paviršiuje, bet ir visame savo tūryje.
Virimo savybės
- Temperatūra: Virimas vyksta, kai skystis pasiekia savo virimo tašką. Kiekvienas skystis turi specifinį virimo tašką, kuris priklauso nuo aplinkos slėgio. Pavyzdžiui, vandens virimo taškas jūros lygyje yra 100 °C.
- Slėgis: Virimo temperatūra priklauso nuo aplinkos slėgio. Esant aukštesniam slėgiui, skysčio virimo taškas didėja, o esant žemesniam slėgiui (pvz., aukštikalnėse), virimo taškas mažėja.
- Visuotinis procesas: Virimas vyksta visame skysčio tūryje, ne tik paviršiuje. Garai susidaro skysčio viduje ir kyla į paviršių, sudarydami burbulus.
- Energijos sąnaudos: Norint išlaikyti virimo procesą, reikia nuolat tiekti šilumos energiją, kad būtų kompensuojama garų išsiskyrimo energija.
Virimo pavyzdžiai
- Vandens virimas: Puodui su vandeniu pasiekus 100 °C temperatūrą (jūros lygyje), vanduo pradeda virti, formuodamas garų burbulus visame savo tūryje.
- Maisto ruošimas: Daugelis maisto produktų verdami karštame vandenyje, pavyzdžiui, makaronai ar kiaušiniai.
Kas yra garavimas?
Garavimas yra procesas, kai skystis virsta garais tik jo paviršiuje, net nesiekdamas virimo taško. Tai reiškia, kad garavimas vyksta bet kurioje temperatūroje, žemesnėje už virimo tašką.
Garavimo savybės
- Temperatūra: Garavimas vyksta bet kurioje temperatūroje, žemesnėje už skysčio virimo tašką. Skirtingai nuo virimo, garavimas vyksta ir kambario temperatūroje.
- Slėgis: Garavimo greitis priklauso nuo aplinkos slėgio, tačiau pats procesas gali vykti bet kokiame slėgyje.
- Paviršinis procesas: Garavimas vyksta tik skysčio paviršiuje. Molekulės, esančios paviršiuje, gauna pakankamai energijos, kad ištrūktų iš skysčio ir taptų garais.
- Energijos sąnaudos: Garavimas yra lėtas procesas, kuris nereikalauja nuolatinio šilumos tiekimo kaip virimas. Energija reikalinga tik paviršiaus molekulėms, kad jos galėtų išgaruoti.
Garavimo pavyzdžiai
- Vandens garavimas: Vanduo išsiliejęs ant paviršiaus garuoja kambario temperatūroje.
- Džiovinimas: Drabužiai džiūsta lauke, nes vanduo iš jų garuoja į aplinkos orą.
Pagrindiniai skirtumai
| Aspektas | Virimas | Garavimas |
|---|---|---|
| Temperatūra | Vyksta pasiekus virimo tašką | Vyksta bet kurioje temperatūroje, žemesnėje už virimo tašką |
| Slėgis | Priklauso nuo aplinkos slėgio, keičia virimo tašką | Garavimo greitis priklauso nuo slėgio, bet procesas gali vykti bet kokiame slėgyje |
| Procesas | Vyksta visame skysčio tūryje | Vyksta tik skysčio paviršiuje |
| Energijos sąnaudos | Reikia nuolatinio šilumos tiekimo | Energija reikalinga tik paviršiaus molekulėms |
| Pavyzdžiai | Vandens virimas puode, maisto virimas | Vandens garavimas kambario temperatūroje, drabužių džiūvimas |
Apibendrinant
Virimas ir garavimas yra du skirtingi procesai, kuriais skystis virsta garais. Virimas vyksta pasiekus specifinį skysčio virimo tašką ir apima visą skysčio tūrį, reikalaujant nuolatinio šilumos tiekimo. Garavimas, kita vertus, vyksta bet kurioje temperatūroje, žemesnėje už virimo tašką, ir apima tik skysčio paviršių, todėl nereikia nuolatinio šilumos tiekimo. Supratę šiuos skirtumus, galime geriau suprasti, kaip ir kodėl šie procesai vyksta kasdieniame gyvenime.
Šaltiniai: